TABAGISMO e COVID-19

1. O que causa e como evolui a COVID-19?
A COVID-19 é uma doença sistêmica causada pelo Coronavírus SARS-CoV-2, a qual apresenta um quadro clínico que varia desde infecções assintomáticas a quadros respiratórios graves e disfunção de vários órgãos. De acordo com a Organização Mundial de Saúde (OMS), estima-se que 80% dos casos sejam assintomáticos ou leves, enquanto 20% são formas moderadas a graves, que requerem atendimento hospitalar por apresentarem dificuldade respiratória. Destes últimos, 5% são formas críticas, que necessitam de suporte ventilatório para o tratamento da insuficiência respiratória(1).
Entre os indivíduos que evoluem para os quadros mais graves da COVID-19, estão aqueles que apresentam comorbidades clínicas, dentre as quais o diabetes mélito, hipertensão arterial sistêmica, doença pulmonar obstrutiva crônica (DPOC) e câncer. Todas essas doenças têm relação com o tabagismo (2,3).
2. O risco de transmissão da COVID-19 aumenta nas pessoas com histórico de tabagismo?
Até a presente data, não há evidência científica que comprove que a história de tabagismo aumente o risco de transmissão da COVID-19.
Entretanto, é plausível admitir que o compartilhamento de qualquer produto derivado do tabaco seja uma via de transmissão do SARS-CoV-2 (4). Tomamos como exemplo o narguilé que, habitualmente, é usado em grupos, onde a partilha das piteiras e mangueiras, sem a prévia e correta esterilização, faz parte da rotina de uso desse dispositivo(5). Usuários de cigarros tradicionais e eletrônicos, que sejam portadores assintomáticos do novo Coronavírus podem contribuir, de forma involuntária, na propagação da COVID-19 (6).
3. O consumo de tabaco aumenta o risco de desenvolver a infecção pela COVID-19?
Sim, fumantes e ex-fumantes de qualquer tipo de produto derivado do tabaco têm maior risco de desenvolver a COVID-19, inclusive em sua forma mais grave, que pode culminar com a morte(7).
Sabe-se que a exposição à fumaça do tabaco é o principal fator de risco para doença pulmonar e que fumar cigarros é um importante fator de risco para infecções bacterianas, virais e tuberculose, devido às mudanças estruturais no trato respiratório e redução de sua resposta imune (8). Isto pode ser válido também para os usuários de dispositivos eletrônicos para fumar (DEF´s), como os cigarros eletrônicos e o tabaco aquecido.
A epidemia MERS-CoV de 2012-1015, no Oriente Médio, apresentou os mesmos achados clínicos da atual COVID-19 e os relatos indicaram associação significativa entre tabagismo e taxa de mortalidade(9). Estudo prévio demonstrou que fumantes têm duas vezes mais chances que não fumantes de contrair influenza, ter sintomas mais graves, bem como apresentarem maior mortalidade, como no surto anterior de MERS-CoV (10).
Por outro lado, a exposição à fumaça do tabaco aumenta a inflamação na mucosa respiratória e a expressão de citocinas inflamatórias e o fator de necrose tumoral; aumenta a permeabilidade da barreira alvéolo-capilar, com edema e espessamento septal e hipersecreção mucosa, com comprometimento da função de transporte mucociliar. Assim, conhecer os fatores evitáveis do hospedeiro, como o tabagismo, pode ser importante na redução da contaminação viral e da gravidade da doença (11,12).
4. O uso de narguilé, cigarro eletrônico e de tabaco aquecido aumenta o risco de infecção pela COVID-19?
Em relação ao narguilé, além do risco de inalação de sua fumaça, há ainda o risco adicional de contaminação pelo SARS-Cov-2, através do compartilhamento do bocal entre seus usuários (13).
O uso de cigarros eletrônicos também aumenta o risco de infecção pelo SARS-Cov-2. Esses sistemas geralmente contêm nicotina, mas também aromas e outros produtos químicos, ou mesmo até maconha. Eles trabalham aquecendo o líquido ou óleo fornecido nos cartuchos, para produzir um aerossol com vapor que é inalado pelos pulmões (14).
Em 2019, usuários desses produtos apresentaram lesões nos pulmões que resultaram em insuficiência respiratória aguda, internação em Unidade de Terapia Intensiva (UTI) e algumas mortes. Este quadro clínico passou a ser denominado E-cigarette, or Vaping, product use–Associated Lung Injury (EVALI) (15). Portanto, devido à sua toxicidade pulmonar, os usuários de cigarros eletrônicos apresentam aumento do risco para a COVID-19. Além disso, os aerossóis e os vapores gerados pelos sistemas eletrônicos podem participar da disseminação do vírus nos ambientes em que se encontram os usuários desses produtos, aumentando o risco de contaminação pelo SARS-CoV-2 (14).
Os dispositivos de tabaco aquecido, como por exemplo o IQOS®, produzem aerossóis, durante o aquecimento do tabaco, contendo nicotina e produtos químicos tóxicos. Não há evidências que demonstrem que essas substâncias sejam menos prejudiciais do que aquelas encontradas nos produtos de tabaco convencionais. Estudos independentes mostraram mais de 20 substâncias químicas nocivas e potencialmente prejudiciais, em concentrações maiores do que na fumaça dos cigarros convencionais, sendo algumas delas cancerígenas. Também foram relatadas outras substâncias não encontradas na fumaça do cigarro(16).
As evidências sugerem que os usuários de tabaco aquecido apresentam os mesmos riscos em complicações da COVID-19 do que os usuários dos demais produtos de tabaco. (16) O uso de narguilés e cigarros eletrônicos é um risco para a transmissão da COVID-19, pois o usuário exala gotículas de vapor, propagando o SARS-Cov-2 (17,18).

5. O uso de tabaco é um fator de risco para a progressão da COVID-19?
A principal entrada do SARS-Cov-2 no organismo se dá pela mucosa do nariz, boca, vias aéreas superiores e, menos frequentemente, pela mucosa conjuntival. Na síndrome de angústia respiratória severa (SARS), causada pelo SARS-CoV-2, há envolvimento dos receptores da enzima conversora da angiotensina II (ECA2), que são abundantes nas células da mucosa epitelial respiratória (pneumócitos tipo II) e no tecido alveolar pulmonar (10,11,19–21). A expressão genética da ECA2 é maior no epitélio das grandes e pequenas vias aéreas de fumantes (atuais ou ex-fumantes), em comparação a quem nunca fumou22,23).
Este aumento da expressão genética da ECA2 (upregulation) associado ao tabagismo sugere que fumar contribui para o aumento dos receptores virais sendo, portanto, um importante fator de risco para complicações e prognóstico reservado na infecção pelo SARS-CoV-2, o que não é observado em infectados não fumantes (11,24,25).
Em resumo, fumar é fator de risco para a progressão da COVID-19. Portanto, profissionais de saúde e médicos devem coletar dados sobre o tabagismo como parte da história e do controle clínico dos pacientes e incluir a cessação na lista de práticas para o controle da pandemia COVID-19(7).

6. A nicotina exerce algum papel na resposta imunológica pulmonar na COVID-19?
O tabagismo é prejudicial ao sistema imunológico e sua capacidade de resposta a infecções, tornando os fumantes mais vulneráveis a doenças infecciosas (19).
Metanálise recente sugere que o tabagismo ativo está significativamente associado ao risco de manifestação grave da COVID-19 (26). Outros estudos têm avaliado a hipótese da exposição à nicotina aumentar o risco da entrada do SARS-CoV-2 nas células pulmonares (27), já que esta tem reconhecida influência na homeostase do sistema renina-angiotensina (SRA), o qual regula positivamente a enzima conversora de angiotensina (ECA) e diminui a regulação do ECA2 compensatório, o que contribui, por sua vez, para o desenvolvimento de doenças cardiovasculares e pulmonares(28).
As diferentes células das vias aéreas, como células epiteliais brônquicas, pneumócitos tipo II e fibroblastos intersticiais, expressam receptores nicotínicos de acetilcolina (nAChR), especificamente o subtipo α7 (29) e componentes do SRA. A nicotina, além disso, aumenta a expressão e/ou a atividade da ECA no pulmão, aumento observado também no sangue de fumantes (28). Desta forma, os estudos sugerem que a nicotina possa promover mecanismos de captação celular da SARS CoV-2, através da sinalização de α7-nAChR (29).

7. Há relação entre a resposta imunológica pulmonar causada pelo tabagismo e a infecção pela COVID-19?
Cada vez mais surgem evidencias que confirmam o envolvimento do tabagismo como fator predisponente chave para a gravidade e mortalidade da COVID-19. O uso crônico de nicotina através dos derivados do tabaco, de forma direta ou indireta, é um importante fator de vulnerabilidade para a COVID-19, em várias populações(2).
Baseando-se na elevada expressão ECA2 presente nos pneumócitos tipo II, nos macrófagos alveolares e no epitélio das pequenas vias aéreas em fumantes, especulou-se que o tabagismo pode ser fator de risco, uma vez que esta enzima tem importante papel como receptor funcional para a entrada do vírus na célula (endocitose) e sua subsequente replicação, nos casos de SARS-CoV-2, podendo assim contribuir para o aumento da gravidade e mortalidade pela COVID-19 (22).
Ao se ligar à ECA2, o vírus provoca o aumento da lesão pela angiotensina II e diminuição da proteção pela angiotensina 1-7, o que acarreta aumento da inflamação, vasoconstrição, exsudação de neutrófilos, macrófagos, fibrina e trombose(20,30). Assim, o efeito do aumento significativo na expressão pulmonar da ECA2, causado pelo tabagismo, sugere risco aumentado para ligação viral e entrada nos pulmões de fumantes, sugerindo então que estes têm maior susceptibilidade à infecção, maior gravidade da doença e pior desfecho após o tratamento(31,32).
Também é sabido que o tabagismo provoca a ativação de citocinas inflamatórias e apoptose no tecido pulmonar, além de ações diretas sobre as células circulantes do sistema imunológico. Desta forma, a exposição à nicotina de forma sistemática e prolongada, através das várias formas de consumo do tabaco, provém mecanismo celular para a susceptibilidade viral e gravidade da doença durante o curso de uma infecção nos pulmões e em outros órgãos (27).
Em resumo, em fumantes, ex-fumantes e pessoas com DPOC, há aumento (upregulation) da expressão da ECA2 nas vias aéreas inferiores, o que pode explicar, em parte, o risco aumentado de manifestações graves da COVID-19 nessas populações. Esses achados chamam a atenção da importância de cessar o tabagismo e aumentar a vigilância nesta população, para a prevenção e o diagnóstico rápido da COVID-19, uma doença potencialmente letal (23).

8. Quais são os mecanismos de lesão do endotélio vascular causados pelo tabagismo?
O endotélio vascular, quando saudável, tem um papel muito importante na regulação da integridade e do metabolismo da parede vascular, sendo responsável pela função vasodilatadora, anticoagulante e anti-inflamatória, que são fundamentais para a manutenção da homeostasia (33). Os danos causados pelo tabagismo ao endotélio vascular são complexos e variados e, entre eles, citamos o estresse oxidativo, a inflamação e as alterações na coagulação(34).
O estresse oxidativo reduz a biodisponibilidade do óxido nítrico (NO), uma molécula protetora dos vasos sanguíneos, causando danos ao endotélio do fumante, o que o torna permeável para liberar toxinas aos tecidos do corpo (33,35). O fumante apresenta níveis séricos elevados de citocinas pró-inflamatórias (36), entre elas algumas interleucinas (IL-1b, IL-6) e de fatores de necrose tumoralalfa (37), que promovem um processo inflamatório no endotélio vascular. O aumento do estresse oxidativo e das citocinas circulantes causa inflamação dos vasos sanguíneos e disfunção endotelial (37).
A Proteína C Reativa (PCR), um reagente inflamatório de fase aguda, é capaz de aumentar a expressão do fator tecidual nos monócitos (38,39), um precipitador da coagulação in vivo, ou seja, da trombose, enquanto o Dímero-D se constitui de vestígios de proteínas liberadas durante a coagulação (40). Estes dois marcadores estão aumentados nos fumantes, prejudicando a função fisiológica de anticoagulação do endotélio e predispondo-os a eventos trombóticos e tromboembólicos (6,8).
9. Há relação entre os danos ao endotélio vascular causados pelo tabagismo e a infecção pela COVID-19?
Por ser o endotélio o maior sistema do corpo humano, revestindo todos os vasos sanguíneos, desde o coração até os pequenos capilares (41), a sua disfunção está intimamente ligada à maioria das doenças tabaco- relacionadas.
Partindo da premissa de que os fumantes podem desenvolver uma lesão endotelial sistêmica que predispõe à trombose e à embolia pulmonar aguda, é razoável a hipótese da sua maior chance de complicações face à contaminação pelo novo Coronavírus. O tabagismo eleva as concentrações de radicais livres no corpo, bem como os quadros agudos de infecções microbianas, como a COVID-19 (42).
Assim como nos fumantes, os indivíduos contaminados com o novo Coronavírus apresentam elevações de algumas interleucinas, (IL-2, IL-7) e do fator de necrose tumoralalfa, o que contribui para a síndrome de tempestade de citocinas, responsável pelas graves lesões endoteliais, observadas em um subgrupo de pacientes que evoluem para a forma grave da COVID-19, com excesso de inflamação e síndrome de disfunção de múltiplos órgãos (SDMO) (43).
Entretanto, não está claro se essas complicações ocorrem pela resposta imunológica desregulada, que desencadeia importante disfunção endotelial ou distúrbio da coagulação, que é verificada nos casos graves da COVID-19(44,45). Além disto, a infecção pelo novo Coronavírus cursa também com elevação dos níveis de Proteína C Reativa (PCR) e Dímero-D (46,47) que já são elevadas nos fumantes(38,40), sendo plausível pensarmos numa evolução com manifestações mais graves da COVID-19.
Estudo constatou que a coagulação intravascular disseminada estava presente em 71% dos casos de COVID-19 que evoluíram para óbito, comparado com 0,4% dos que superaram a doença. Observou-se nesses casos um aumento de 3 a 4 vezes do Dímero-D, comparado aos níveis encontrados na admissão hospitalar (48). A chance de evolução para óbito pela SDMO aumenta em 18 vezes, nos casos de elevação do Dímero-D (acima de 1μg / L) na admissão(47,49).
A elevação desses marcadores, em especial do Dímero-D, indica que abordagens mais críticas e agressivas serão necessárias, face à gravidade progressiva do quadro infeccioso causado pelo SARS-CoV-2 (50).
Em resumo, os fumantes fazem parte do grupo de risco para a contaminação e complicações da COVID-19, não somente pelas comorbidades tabaco-relacionadas preexistentes, mas também porque apresentam elevados níveis de PCR, Dímero-D (38,40) e dascitocinas pró-inflamatórias (36).
10. Há relação entre os danos ao sistema hematológico causados pela COVID-19 e o tabagismo?
A COVID‐19 é uma infecção que envolve múltiplos órgãos e sistemas, incluindo o hematopoiético e o hemostático (51,52). Uma das mais recentes observações clínicas em pacientes infectados é um quadro de hipoxemia silenciosa grave, de caráter progressivo(53–55).
A cada tragada de fumaça de cigarros ou produtos similares, o fumante inala considerável volume de monóxido de carbono (CO). A grande afinidade de ligação do CO com a hemoglobina gera a carboxiemoglobina, que diminui a oxigenação dos tecidos e órgãos (hipóxia) resultando em menor tolerância ao exercício e menor capacidade aeróbica (56–62). A hipóxia gera processo um inflamatório generalizado, disfunção endotelial e, um quadro de hipercoagulabilidade(63), tanto entre pacientes com COVID-19 quanto entre fumantes.
Na infecção pela COVID-19 a hipóxia tem evolução rápida, desencadeia um processo inflamatório agudo com aumento do nível de fibrinogênio e Dímero-D, que pode evoluir para coagulação intravascular disseminada, danos microvasculares trombóticos e uma tempestade de citocinas inflamatórias, resultando em maior permeabilidade vascular, síndrome de disfunção de múltiplos órgãos e morte (48,50,64–66).
Entre fumantes, a hipóxia crônica e a exposição a outras substâncias tóxicas da fumaça do tabaco levam à disfunção do endotélio dos vasos sanguíneos e a um processo inflamatório crônico, também mediado por citocinas(37). Por sua vez, esse processo contribui para um estado de hipercoagulabilidade, caracterizado principalmente por aumento na agregação das plaquetas, aumento da produção de fibrinogênio pelo fígado e disfunções no processo de fibrinólise, importante mecanismo regulador do sistema hemostático que evita a formação e remove os trombos intravasculares(67–70).
Esse desequilíbrio crônico nas funções de coagulação e anticoagulação explicam, em parte, o maior risco de fenômenos tromboembólicos entre fumantes, sendo plausível que estas alterações os tornem mais vulneráveis a mecanismos fisiopatogênicos similares observados na infecção pelo novo Coronavírus e expliquem o porquê tendem a evoluir com um quadro mais grave quando infectados(71).
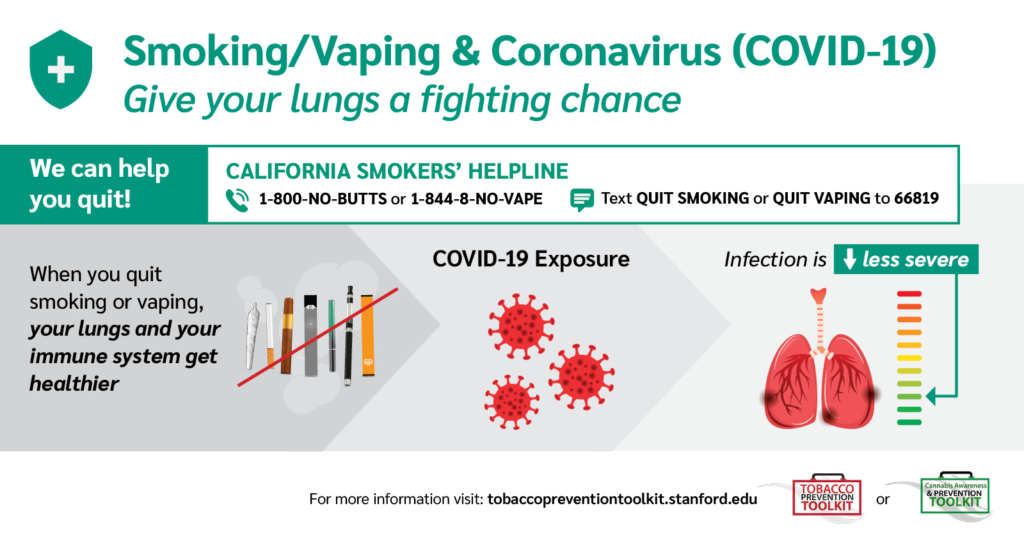
11. Parar de fumar reduz o risco de transmissão e/ou infecção pela COVID-19?
Sabemos que o tabagismo provoca alterações importantes nos mecanismos de defesa do organismo e, em especial, no trato respiratório, além de mutação no DNA das células. A infecção pelo SARS-CoV-2 tem como um dos principais órgãos de choque os pulmões e sua rica vascularização. Neste triste cenário da pandemia, parar de fumar deveria ser visto como uma importante janela de oportunidade (72–74).
Embora ainda não existam dados avaliando os benefícios da cessação do tabagismo durante a epidemia da COVID-19, as evidências sugerem que parar de fumar por quatro semanas ou mais, melhora o clearance mucociliar e a função imune pulmonar, reduzindo o risco de desenvolver COVID-19 e suas graves complicações, bem como outras infecções pulmonares (75).
A hipóxia decorrente da intoxicação crônica por monóxido de carbono (CO) tende a desaparecer depois das primeiras 8 horas sem fumar (59). Depois de um dia sem fumar, observa-se também a recuperação da disfunção do endotélio vascular e, após duas semanas, ocorre a normalização da agregação plaquetária e do nível de fibrinogênio no sangue, o que por sua vez reduz os riscos de eventos tromboembólicos e cardíacos entre fumantes(71,76). Já outros marcadores hemostáticos e de inflamação decorrentes do tabagismo se reduzem em 50% após um período de 5 a 9 anos de abstinência continuada (77).A função endotelial denota um importante impacto positivo face à cessação do tabagismo(78).
Portanto, parar de fumar é uma importante medida de proteção, que deve ser divulgada aos fumantes, como forma de motivá-los a pararem de fumar, reduzindo as chances de complicações caso o fumante venha a se infectar com o SARS-CoV-2.

Referências
1. World Health Organization. Coronavirus [Internet]. [citado 19 de maio de 2020]. Disponível em: https://www.who.int/emergencies/diseases/novel-coronavirus-2019
2. Guan W, Liang W, Zhao Y, Liang H, Chen Z, Li Y, et al. Comorbidity and its impact on 1590 patients with Covid-19 in China: A Nationwide Analysis. European Respiratory Journal [Internet]. 1o de janeiro de 2020 [citado 12 de maio de 2020]; Disponível em: https://erj.ersjournals.com/content/early/2020/03/17/13993003.00547-2020
3. Zhao Q, Meng M, Kumar R, Wu Y, Huang J, Lian N, et al. The impact of COPD and smoking history on the severity of COVID-19: A systemic review and meta-analysis. J Med Virol. 15 de abril de 2020;
4. Oliveira da Silva AL, Costa Moreira J, Martins SR. COVID-19 e tabagismo: uma relação de risco. CSP [Internet]. maio de 2020;36(5). Disponível em: http://cadernos.ensp.fiocruz.br/csp/artigo/1060/covid-19-e-tabagismo-uma-relao-de-risco
5. Instituto Nacional de Câncer José Alencar Gomes da Silva. Narguilé: o que sabemos? Stella Martins (elaboração). Rio de Janeiro: INCA, 2019, 100 p. ISBN 978-85-7318-382-5 (versão eletrônica) [Internet]. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files//media/document//narguile-o-que-sabemos.pdf
6. COVID-19 e o tabagismo: por que os fumantes correm mais riscos? [Internet]. Sociedade Brasileira de Pneumologia e Tisiologia. 2020 [citado 13 de maio de 2020]. Disponível em: https://sbpt.org.br/portal/tabagismo-covid-sbpt/
7. Patanavanich R, Glantz SA. Smoking is Associated with COVID-19 Progression: A Meta-Analysis. medRxiv. 16 de abril de 2020;2020.04.13.20063669.
8. Arcavi L, Benowitz NL. Cigarette smoking and infection. Arch Intern Med. 8 de novembro de 2004;164(20):2206–16.
9. Nam H-S, Park JW, Ki M, Yeon M-Y, Kim J, Kim SW. High fatality rates and associated factors in two hospital outbreaks of MERS in Daejeon, the Republic of Korea. Int J Infect Dis. Maio de 2017; 58:37–42.
10. Park J-E, Jung S, Kim A, Park J-E. MERS transmission and risk factors: a systematic review. BMC Public Health [Internet]. 2 de maio de 2018 [citado 12 de maio de 2020];18. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5930778/
11. Liu W, Tao Z-W, Lei W, Ming-Li Y, Kui L, Ling Z, et al. Analysis of factors associated with disease outcomes in hospitalized patients with 2019 novel coronavirus disease. Chinese Medical Journal [Internet]. 3 de abril de 2020 [citado 6 de abril de 2020]; Publish Ahead of Print. Disponível em: https://journals.lww.com/cmj/Abstract/publishahead/Analysis_of_factors_associated_with_disease.99363.aspx
12. Berlin I, Thomas D, Le Faou A-L, Cornuz J. COVID-19 and Smoking. Nicotine Tob Res [Internet]. 3 de abril de 2020 . Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7184428/
13. Increased risk of COVID-19 infection amongst smokers and amongst waterpipe users [Internet]. WHO FCTC Secretariat’s Knowledge Hub on waterpipes. 2020 [citado 15 de abril de 2020]. Disponível em: https://untobaccocontrol.org/kh/waterpipes/covid-19/
14. Javelle E. Electronic cigarette and vaping should be discouraged during the new coronavirus SARS-CoV-2 pandemic. Arch Toxicol. 18 de abril de 2020;1–2.
15. Centers for Disease Control and Prevention, Smoking & Tobacco Use. Smoking and Tobacco Use; Electronic Cigarettes. Outbreak of Lung Injury Associated with the Use of E-Cigarette, or Vaping, Products [Internet]. Centers for Disease Control and Prevention. 2020 . Disponível em: https://www.cdc.gov/tobacco/basic_information/e-cigarettes/severe-lung-disease.html
16. World Health Organization. Tobacco [Internet]. [citado 19 de maio de 2020]. Disponível em: https://www.who.int/news-room/fact-sheets/detail/tobacco
17. Kalan ZBT, Mehdi Fazlzadeh, Kenneth D Ward, Wasim. Maziak. Waterpipe Tobacco Smoking – A Potential Conduit of COVID-19. 2020 [citado 19 de maio de 2020]; Disponível em: https://vpha.org.vn/en/news/waterpipe-tobacco-smoking-a-potential-conduit-of-covid-19.html
18. Garg S, Deshmukh C. Tobacco: An invisible and immediate threat for COVID 19. Indian Journal of Community Health. 18 de abril de 2020;32(2 (Supp)):248–50.
19. Vardavas CI, Nikitara K. COVID-19 and smoking: A systematic review of the evidence. Tob Induc Dis [Internet]. 20 de março de 2020 [citado 12 de maio de 2020];18(March). Disponível em: http://www.tobaccoinduceddiseases.org/COVID-19-and-smoking-A-systematic-review-of-the-evidence,119324,0,2.html
20. Li G, He X, Zhang L, Ran Q, Wang J, Xiong A, et al. Assessing ACE2 expression patterns in lung tissues in the pathogenesis of COVID-19. J Autoimmun [Internet]. 13 de abril de 2020 . Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7152872/
21. Tay MZ, Poh CM, Rénia L, MacAry PA, Ng LFP. The trinity of COVID-19: immunity, inflammation and intervention. Nat Rev Immunol. 28 de abril de 2020;
22. Brake SJ, Barnsley K, Lu W, McAlinden KD, Eapen MS, Sohal SS. Smoking Upregulates Angiotensin-Converting Enzyme-2 Receptor: A Potential Adhesion Site for Novel Coronavirus SARS-CoV-2 (Covid-19). J Clin Med [Internet]. 20 de março de 2020;9(3). Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7141517/
23. Leung JM, Yang CX, Tam A, Shaipanich T, Hackett T-L, Singhera GK, et al. ACE-2 Expression in the Small Airway Epithelia of Smokers and COPD Patients: Implications for COVID-19. Eur Respir J [Internet]. 8 de abril de 2020; Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7144263/
24. Vardavas CI, Nikitara K. COVID-19 and smoking: A systematic review of the evidence. Tob Induc Dis [Internet]. 20 de março de 2020 [citado 15 de abril de 2020];18(March). Disponível em: http://www.tobaccoinduceddiseases.org/COVID-19-and-smoking-A-systematic-review-of-the-evidence,119324,0,2.html
25. Hefler M, Editor N. Smoking history is an important risk factor for severe COVID-19 [Internet]. Blog – Tobacco Control. 2020 [citado 6 de abril de 2020]. Disponível em: https://blogs.bmj.com/tc/2020/04/05/smoking-history-is-an-important-risk-factor-for-severe-covid-19/
26. Guo FR. Active smoking is associated with severity of coronavirus disease 2019 (COVID-19): An update of a meta-analysis. Tob Induc Dis. 2020;18:37.
27. Olds JL, Kabbani N. Is nicotine exposure linked to cardiopulmonary vulnerability to COVID-19 in the general population? FEBS J [Internet]. 18 de março de 2020; Disponível em: https://febs.onlinelibrary.wiley.com/doi/full/10.1111/febs.15303
28. Oakes JM, Fuchs RM, Gardner JD, Lazartigues E, Yue X. Nicotine and the renin-angiotensin system. Am J Physiol Regul Integr Comp Physiol. 01 de 2018;315(5):R895–906.
29. Cardinale A, Nastrucci C, Cesario A, Russo P. Nicotine: specific role in angiogenesis, proliferation and apoptosis. Crit Rev Toxicol. janeiro de 2012;42(1):68–89.
30. Xu Z, Shi L, Wang Y, Zhang J, Huang L, Zhang C, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. The Lancet Respiratory Medicine. 1o de abril de 2020;8(4):420–2.
31. Liu Peter P., Blet Alice, Smyth David, Li Hongliang. The Science Underlying COVID-19: Implications for the Cardiovascular System. Circulation [Internet]. [citado 12 de maio de 2020];0(0). Disponível em: https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.120.047549
32. Cai G, Bossé Y, Xiao F, Kheradmand F, Amos CI. Tobacco Smoking Increases the Lung Gene Expression of ACE2, the Receptor of SARS-CoV-2. Am J Respir Crit Care Med [Internet]. 24 de abril de 2020
33. Rajendran P, Rengarajan T, Thangavel J, Nishigaki Y, Sakthisekaran D, Sethi G, et al. The Vascular Endothelium and Human Diseases. Int J Biol Sci. 9 de novembro de 2013;9(10):1057–69.
34. Csiszar A, Podlutsky A, Wolin MS, Losonczy G, Pacher P, Ungvari Z. Oxidative stress and accelerated vascular aging: implications for cigarette smoking. Front Biosci (Landmark Ed). 1o de janeiro de 2009;14:3128–44.
35. Förstermann U. Nitric oxide and oxidative stress in vascular disease. Pflugers Arch. maio de 2010;459(6):923–39.
36. Bermudez EA, Rifai N, Buring JE, Manson JE, Ridker PM. Relation between markers of systemic vascular inflammation and smoking in women. Am J Cardiol. 1o de maio de 2002;89(9):1117–9.
37. Barbieri SS, Zacchi E, Amadio P, Gianellini S, Mussoni L, Weksler BB, et al. Cytokines present in smokers’ serum interact with smoke components to enhance endothelial dysfunction. Cardiovasc Res. 1o de junho de 2011;90(3):475–83.
38. Das I. Raised C-reactive protein levels in serum from smokers. Clin Chim Acta. 29 de novembro de 1985;153(1):9–13.
39. Cermak J, Key NS, Bach RR, Balla J, Jacob HS, Vercellotti GM. C-reactive protein induces human peripheral blood monocytes to synthesize tissue factor. Blood. 15 de julho de 1993;82(2):513–20.
40. Lee AJ, Fowkes GR, Lowe GD, Rumley A. Determinants of fibrin D-dimer in the Edinburgh Artery Study. Arterioscler Thromb Vasc Biol. agosto de 1995;15(8):1094–7.
41. Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P. Blood Vessels and Endothelial Cells. Molecular Biology of the Cell 4th edition [Internet]. 2002 [citado 6 de maio de 2020]; Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK26848/
42. Evora PRB, Baldo CF, Celotto AC, Capellini VK. Endothelium dysfunction classification: why is it still an open discussion? Int J Cardiol. 2 de outubro de 2009;137(2):175–6.
43. Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ. COVID-19: consider cytokine storm syndromes and immunosuppression. The Lancet. 28 de março de 2020;395(10229):1033–4.
44. Mezger M, Nording H, Sauter R, Graf T, Heim C, von Bubnoff N, et al. Platelets and Immune Responses During Thromboinflammation. Front Immunol. 2019;10:1731.
45. Schulz C, Engelmann B, Massberg S. Crossroads of coagulation and innate immunity: the case of deep vein thrombosis. J Thromb Haemost. junho de 2013;11 Suppl 1:233–41.
46. Zhang J-J, Dong X, Cao Y-Y, Yuan Y-D, Yang Y-B, Yan Y-Q, et al. Clinical characteristics of 140 patients infected with SARS-CoV-2 in Wuhan, China. Allergy [Internet]. 19 de fevereiro de 2020; Disponível em: https://onlinelibrary.wiley.com/doi/full/10.1111/all.14238
47. Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 28 de 2020;395(10229):1054–62.
48. Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost [Internet]. 27 de março de 2020; Disponível em: https://onlinelibrary.wiley.com/doi/full/10.1111/jth.14817
49. Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA [Internet]. 7 de fevereiro de 2020; Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7042881/
50. COVID-19 and Coagulopathy – Hematology.org [Internet]. [citado 15 de abril de 2020]. Disponível em: https://www.hematology.org:443/covid-19/covid-19-and-coagulopathy
51. Terpos E, Ntanasis‐Stathopoulos I, Elalamy I, Kastritis E, Sergentanis TN, Politou M, et al. Hematological findings and complications of COVID-19. American Journal of Hematology [Internet]. [citado 13 de maio de 2020];n/a(n/a). Disponível em: https://onlinelibrary.wiley.com/doi/abs/10.1002/ajh.25829
52. Agusti Tellez Duarte. Is COVID-19 an Hematologic Disease? [Internet]. Reserchgate Discussion. 2020 [citado 13 de maio de 2020]. Disponível em: https://www.researchgate.net/post/Is_COVID-19_an_Hematologic_Disease
53. “Silent Hypoxemia” and Clinical Observations in COVID-19 [Internet]. Medscape. [citado 13 de maio de 2020]. Disponível em: http://www.medscape.com/viewarticle/928803
54. Ottestad W, Seim M, Mæhlen JO. COVID-19 with silent hypoxemia. Tidsskrift for Den norske legeforening [Internet]. 21 de abril de 2020 [citado 13 de maio de 2020]; Disponível em: https://tidsskriftet.no/en/2020/04/kort-kasuistikk/covid-19-silent-hypoxemia
55. “Silent hypoxia” may be killing some COVID-19 patients. But there’s hope. | Live Science [Internet]. [citado 13 de maio de 2020]. Disponível em: https://www.livescience.com/silent-hypoxia-killing-covid-19-coronavirus-patients.html
56. Fricker M, Goggins BJ, Mateer S, Jones B, Kim RY, Gellatly SL, et al. Chronic cigarette smoke exposure induces systemic hypoxia that drives intestinal dysfunction. JCI Insight [Internet].
57. Astrup Poul. Carbon Monoxide, Smoking, and Cardiovascular Disease. Circulation. 1o de dezembro de 1973;48(6):1167–8.
58. Recurrent Carbon Monoxide Poisoning Due to Smoking Leading to Cognitive Decline – CHEST [Internet]. [citado 13 de maio de 2020]. Disponível em: https://journal.chestnet.org/article/S0012-3692(16)56635-5/fulltext
59. Sandberg A, Sköld CM, Grunewald J, Eklund A, Wheelock ÅM. Assessing recent smoking status by measuring exhaled carbon monoxide levels. PLoS ONE. 2011;6(12):e28864.
60. Milman N, Pedersen AN. Blood haemoglobin concentrations are higher in smokers and heavy alcohol consumers than in non-smokers and abstainers: should we adjust the reference range? Ann Hematol. julho de 2009;88(7):687–94.
61. George P. Effects of smoking on cardiovascular function: the role of nicotine and carbon monoxide. Health Science Journal [Internet]. 2014 [citado 13 de maio de 2020];8(2). Disponível em: https://www.hsj.gr/abstract/effects-of-smoking-on-cardiovascular-function-the-role-of-nicotine-and-carbon-monoxide-2732.html
62. Secondary Polycythemia Clinical Presentation: History, Physical, Causes [Internet]. [citado 13 de maio de 2020]. Disponível em: https://emedicine.medscape.com/article/205039-clinical
63. Eltzschig HK, Carmeliet P. Hypoxia and Inflammation. New England Journal of Medicine. 17 de fevereiro de 2011;364(7):656–65.
64. Magro C, Mulvey JJ, Berlin D, Nuovo G, Salvatore S, Harp J, et al. Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: a report of five cases. Transl Res [Internet]. 15 de abril de 2020; Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7158248/
65. Jose RJ, Manuel A. COVID-19 cytokine storm: the interplay between inflammation and coagulation. Lancet Respir Med [Internet]. 27 de abril de 2020 [citado 13 de maio de 2020]; Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7185942/
66. Zhang C, Wu Z, Li J-W, Zhao H, Wang G-Q. The cytokine release syndrome (CRS) of severe COVID-19 and Interleukin-6 receptor (IL-6R) antagonist Tocilizumab may be the key to reduce the mortality. Int J Antimicrob Agents. 29 de março de 2020;105954.
67. Pamukcu B, Oflaz H, Onur I, Cimen A, Nisanci Y. Effect of cigarette smoking on platelet aggregation. Clin Appl Thromb Hemost. dezembro de 2011;17(6):E175-180.
68. Barua Rajat S., Sy Fridolin, Srikanth Sundararajan, Huang Grace, Javed Usman, Buhari Cyrus, et al. Effects of Cigarette Smoke Exposure on Clot Dynamics and Fibrin Structure. Arteriosclerosis, Thrombosis, and Vascular Biology. 1o de janeiro de 2010;30(1):75–9.
69. Nielsen VG, Hafner DT, Steinbrenner EB. Tobacco smoke-induced hypercoagulation in human plasma: role of carbon monoxide. Blood Coagul Fibrinolysis. junho de 2013;24(4):405–10.
70. Pretorius E, Oberholzer HM, van der Spuy WJ, Meiring JH. Smoking and coagulation: the sticky fibrin phenomenon. Ultrastruct Pathol. agosto de 2010;34(4):236–9.
71. Tapson VF. The role of smoking in coagulation and thromboembolism in chronic obstructive pulmonary disease. Proc Am Thorac Soc. 2005;2(1):71–7.
72. Reduce your risk of serious lung disease caused by corona virus by quitting smoking and vaping [Internet]. Center for Tobacco Control Research and Education. [citado 12 de maio de 2020]. Disponível em: https://tobacco.ucsf.edu/reduce-your-risk-serious-lung-disease-caused-corona-virus-quitting-smoking-and-vaping
73. Alerta do INCA à população sobre tabagismo e coronavírus [Internet]. INCA – Instituto Nacional de Câncer. 2020 [citado 12 de maio de 2020]. Disponível em: https://www.inca.gov.br/publicacoes/notas-tecnicas/alerta-do-inca-populacao-sobre-tabagismo-e-coronavirus
74. Alerta do INCA sobre os riscos do tabagismo e do uso e compartilhamento do narguilé para infecção pelo coronavírus (Covid – 19) [Internet]. INCA – Instituto Nacional de Câncer. 2020 [citado 12 de maio de 2020]. Disponível em: https://www.inca.gov.br/publicacoes/notas-tecnicas/alerta-do-inca-sobre-os-riscos-do-tabagismo-e-do-uso-e-compartilhamento
75. Eisenberg S-L, Eisenberg MJ. Smoking Cessation During the COVID-19 Epidemic. Nicotine Tob Res [Internet].
76. Morita H, Ikeda H, Haramaki N, Eguchi H, Imaizumi T. Only two-week smoking cessation improves platelet aggregability and intraplatelet redox imbalance of long-term smokers. J Am Coll Cardiol. 15 de fevereiro de 2005;45(4):589–94.
77. Johnson HM, Gossett LK, Piper ME, Aeschlimann SE, Korcarz CE, Baker TB, et al. Effects of Smoking and Smoking Cessation on Endothelial Function: One-Year Outcomes from a Randomized Clinical Trial. J Am Coll Cardiol. 4 de maio de 2010;55(18):1988–95.
78. Wannamethee SG, Lowe GDO, Shaper AG, Rumley A, Lennon L, Whincup PH. Associations between cigarette smoking, pipe/cigar smoking, and smoking cessation, and haemostatic and inflammatory markers for cardiovascular disease. Eur Heart J. setembro de 2005;26(17):1765–73.
Créditos: Texto elaborado, revisado e ilustrado pelos membros da Comissão de Combate ao Tabagismo da Associação Médica Brasileira e com participação da Dra. Tânia Cavalcante (SE-CONICQ/INCA), atualizado em 12/05/2021.